L'eau
Là
où il y a de l'eau, il y a de la vie ! Pour les animaux aquatiques,
comme les poissons, cette affirmation est d'autant plus vrai, que l'eau
constitue le milieu dans lequel ils évoluent.
L'eau ? Selon les régions, la géologie des sols, etc…,
l'eau a différentes propriétés physiques de telle
sorte qu'il n'y a pas une eau mais des eaux. Chaque espèce a
su s'adapter aux propriétés physiques et chimiques de
leurs eaux et ces caractéristiques devront être satisfaites
en captivité.
Afin de mieux répondre à ses exigences, il convient de
comprendre certaines notions.
Quelles que soient ses propriétés chimiques, l'eau est
constituée de deux atomes d'hydrogènes et d'un atome d'oxygène.
En dessous de 0°C cette eau se transforme en glace (solidification)
et à partir de 100°C, l'eau se transforme en vapeur d'eau
(ébullition). Au cours de sa vie, l'eau traverse divers éléments,
de telle sorte qu'elle se charge de différents corps (alluvions,
fer,…). L'eau dans laquelle vivent les poissons n'est donc pas
pure (de même que celle que nous consommons). Elle contient des
oligo-éléments, du calcium - indispensable à la
fortification du squelette des poissons - ou encore du fer - nécessaire
à la croissance des plantes. Une carence en fer, c'est à
dire un taux inférieur à 0,03 mg/l, se traduit par un
blanchiment des feuilles : la chlorose.
L'eau contient aussi des gaz tels que les incontournables O2 et CO2.
Une eau fortement brassée est plus oxygénée qu'une
eau stagnante et une eau froide est plus riche en O2 qu'une eau tropicale.
Ainsi, les habitants d'eaux stagnantes tropicales (combattants, corydoras,
…) sont habitués à survivre dans des eaux pauvres
en oxygène et sont capables de respirer l'air atmosphérique.
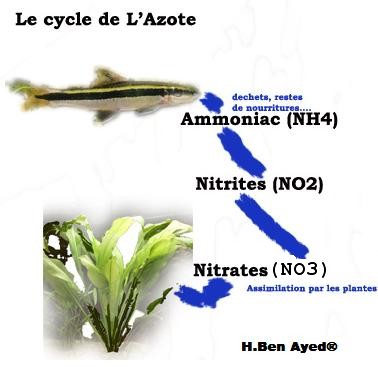
L'activité des animaux (manger, uriner) et la décomposition
des matières organiques entraînent un phénomène
connu sous le nom du cycle de l'azote. L'existence de ce cycle explique
la raison pour laquelle il ne faut pas installer de poissons lors du
démarrage d'un bac. En effet, lors du démarrage du bac,
les bactéries (nitrobacteries notamment) doivent coloniser le
milieu. Cependant cela prend un certain temps et engendre à un
moment (une vingtaine de jours après la mise en eau) un pic de
nitrites (NO2) dangereux pour les poissons. Une fois les bactéries
en place, les nitrites deviennent nitrates et sont dès lors assimilable
par les plantes.
La première étape du cycle de l'azote est le développement
de l'ammoniac (NH4) sous l'effet de la décomposition des déchets
que l'aquarium contient. Cet ammoniac, tant que le taux reste inférieur
à 0,01 mg/l, est inoffensif pour les poissons et assimilable
par les plantes. Cependant, plus le PH est faible, plus l'ammoniac est
susceptible de devenir nocif pour les poissons. Sous l'effet de nitrobacteries,
cet ammoniac est donc transformé en nitrites. Comme nous l'avions
évoqué, les nitrites sont très toxiques pour les
poissons et ils ne doivent jamais dépasser le seuil de 0,1 mg/l.
Comme pour l'ammoniac, plus le PH est faible et plus les nitrites seront
toxiques. Cependant pas d'inquiétude. Dans un aquarium biologiquement
équilibré, la transformation en nitrates (NO3) est rapide.
Les nitrates constituent l'étape finale du cycle de l'azote.
Elles ne sont donc plus transformables, mais ces dernières sont
assimilables par les plantes. Cela veut donc dire, que les nitrates
ont tendance à s'accumuler dans l'eau et que plus l'aquarium
contient de poissons, plus les nitrates s'accumuleront (et inversement
pour les plantes). Cependant pas d'inquiétudes, les nitrates
sont peu toxiques à faible dose. Tant que le taux est inférieur
à 30mg/l, l'eau est considérée comme propre. Au-delà,
il est vivement recommandé d'effectuer un changement partiel
d'eau afin de réduire le taux de nitrates. Un taux de nitrates
supérieur à 100 mg/l rend l'eau impropre à l'aquariophilie.
Au-delà
des différents gaz et des éléments chimiques qui
la compose, les types d'eaux différent par leurs propriétés
physiques (PH, dureté carbonaté, dureté totale).
Le PH est l'unité de mesure de l'eau la plus connue et la plus
simple à utiliser. Le PH peut prendre des valeurs comprises entre
0 et 14, 7 étant le point de neutralité. D'une façon
générale, les poissons vivent dans des eaux dont le PH
est compris entre 5 (Amazonie, eau soumise à une forte décomposition
végétale) et 9 (grands lacs africains où les roches
abondent). Une eau trop acide (PH<5) ou trop basique (PH>9) rend
toute vie aquatique impossible.
La stabilité de ce PH dépend du pouvoir tampon de l'eau. En effet, l'eau est composée de type d'ions : les ions de carbonates (positifs) et les ions de carbonates d'hydrogènes (négatifs). La quantité et la proportion de ces ions vont faire varier le pouvoir tampon de l'eau. Ce pouvoir tampon est mesuré par la dureté carbonaté (exprimé en TAC ou en KH, sachant que 1 TAC=0,56 KH). Plus la dureté carbonatée est élevée, plus le PH sera stable (et élevé). A l'inverse, une faible dureté carbonaté, engendre un faible pouvoir tampon, d'où une instabilité de PH. Il est bon de noter, que même avec une dureté carbonatée élevée, le PH, sous l'effet de l'activité photosynthétique, varie en cours de journée. Ainsi le matin, où l'eau est plus riche en CO2 que le soir, le PH sera inférieur.
Reste
à aborder la dureté totale exprimée en degré
TH (titre hydrométrique) ou en degré GH (1° TH= 0,56029°
GH allemand). L'eau contient des cristaux de calcium et de magnésium.
Si le calcium est indispensable aux poissons, les poissons d'eau douce
(TH<10°) n'en supportent qu'une faible dose, car cette dernière
se développe dans les reins des poissons, ce qui finit par les
affaiblir, puis les tuer. Le magnésium quant à lui est
indispensable à l'activité photosynthétique.
La dureté de l'eau varie surtout en fonction de la nature du
sol et des roches utilisées. En effet, si le sol est de nature
calcaire ou si l'eau est riche en sels, la dureté totale sera
élevée. Si le sol se compose d'un humus végétal,
la dureté sera faible.
La classification des eaux se fait selon le tableau suivant :
| 0°- 10° TH | Eau douce |
| 10° - 15° TH | Eau moyenne |
| 15° TH et plus | Eau dure |
De même qu'il existe une corrélation entre dureté carbonatée et PH, il existe un rapport entre dureté totale et PH. Plus l'eau est dure, plus le PH a des chances d'être élevé.
Afin
de maintenir vos poissons dans de meilleures conditions, l'eau se doit
d'être propre mais aussi de respecter leurs exigences. Afin de
remplir cet objectif, seul des changements d'eau régulier et
des mesures de PH et de dureté, si cela s'avère nécessaire,
sont capables de satisfaire ces exigences. Il est bon de noter qu'une
eau impropre à la consommation l'est aussi à l'aquariophilie.
Si l'eau du robinet de votre région (Bretagne,….) est douteuse,
il peut être interessant de se pencher sur la technique de l'osmose
inverse, afin d'éliminer les impuretés de l'eau….
Hatem Ben Ayed alias Ramses2
03/03/2004

